
导读
美国当地时间2023年6月6日,吴一龙教授将携EVEREST研究,即“佐利替尼”(AZD3759)针对伴中枢神经系统(CNS)转移EGFR敏感突变的晚期非小细胞肺癌(NSCLC)患者的3期随机对照研究,登陆今年ASCO口头报告环节,向世界同行展现又一个中国之声,率先填补EGFR敏感突变NSCLC伴CNS转移治疗领域的1级循证空白。
关注ASCO中国之声,今天我们从EGFR敏感突变NSCLC伴CNS转移的疾病现状和机制开始……
一、高发生率和高致死性使得EGFR敏感突变NSCLC的CNS转移治疗现状不容乐观
CNS转移是NSCLC主要的转移部位之一,EGFR敏感突变NSCLC患者的CNS转移发生率尤其常见:晚期患者初诊时约四分之一已存在脑转移,约一半的患者在3年病程中会发生脑转移[1];约十分之一的EGFR突变阳性患者存在软脑膜转移[2]。CNS转移(脑实质转移和软脑膜转移)严重影响患者生活质量和生存期,根据最终死因分析研究报道,CNS转移相关死亡是CNS转移患者的常见死因,占比高达28%-46% ,软脑膜转移导致CNS转移相关死亡风险显著增高(HR=4.75)[3,4,5]。有研究也显示接近一半的患者发生CNS转移时有转移症状[6],严重影响患者的生活质量[7]。EGFR敏感突变NSCLC患者伴发CNS转移一直是复杂棘手的临床挑战和患者生活生存的重大危害。
二、血脑屏障影响药物入脑(包含转运蛋白外排机制)是CNS转移病灶恶化和治疗耐药的一种重要机制
Preusser M等认为NSCLC原发灶的肿瘤细胞在脱离原发部位进入血液或淋巴系统后,经血行播散,穿过毛细血管内皮细胞和血液和大脑之间形成的可渗透血脑屏障(BBB),进入脑内克隆生长形成转移灶。肿瘤细胞穿过BBB后大部分会被脑部的免疫微环境杀死,仅少数可能存活下来,以休眠形式定植在血管周围,或通过血管生成、侵袭前足、基因组改变及与脑部微环境的相互作用等机制得以生存和生长,进而形成转移瘤[8]。
BBB是药物进入脑部的物理、化学和分子屏障,是一层脑毛细血管内皮细胞组成,经由周细胞,星型胶质末端和基底膜等结构紧密包裹着,具有高跨内皮电阻和低细胞旁及细胞间通透性的结构:除了致密细胞结构形成的物理屏障,还包括各种酶与转运蛋白形成的生化屏障。其中,外排蛋白也称ABC外排药物泵,是一类ATP结合盒(ABC)转运蛋白,包括P-gp (P-糖蛋白,ABCB1)、BCRP(乳腺癌耐药蛋白)、多药耐药相关蛋白1(MRP1,ABCC1)等,是真核细胞中发现的最重要的多药耐药蛋白,在颅内病灶进展、肿瘤干细胞逃逸中起到重要的耐药作用。BBB有效地阻止了98%以上的小分子药物和几乎100% 的大分子药物在大脑中发挥治疗作用,使颅内成为肿瘤细胞的避难所,导致CNS进展[9]。
药物分子入脑,主要通过以下途径:1、被动扩散;2、通过细胞间隙入脑,该方式通常只能对一些极性低分子量的化合物适用;3、由脑毛细血管内皮细胞表达的转运蛋白介导的摄取;4、由脑毛细血管内皮细胞表达的受体蛋白介导的转运。
其中小分子化合物(包括几乎所有EGFR-TKI)都是通过被动扩散实现入脑,但其可能受主动外排转运的拮抗和限制。扩散入脑的药物分子,被外排蛋白主动逆向地以底物结合的形式,从颅内排出;继而引起局部有效药物浓度降低,局部病灶进展,是造成颅内药物治疗原发或继发耐药的一种重要机制。
图1 BBB/BCSFB/BAB外排作用机制
三、增加药物BBB通透性(如非外排蛋白底物设计)是针对CNS转移病灶治疗困境的一种有效解决方法
EGFR-TKI药物发展进程中,伴随着针对耐药突变靶点的研发,通过增加BBB通透性来达到脑部病灶的更优控制,这种设计思路也孕育其中:吉非替尼,厄洛替尼,阿法替尼和奥希替尼BBB通透性分别为1.13%,2.8-3.3%,1.65%和2.5%-16%,相较于第一/二代EGFR-TKI药物,第三代药物的BBB通透性进一步增强[10,15]。奥希替尼的3期临床研究FLAURA中关于包含既往有或无颅内转移症状和颅内放疗的CNS亚组分析、阿美替尼和伏美替尼的3期临床研究中各自入组的无症状CNS转移患者亚组分析数据均显示更优于一代的CNS疗效[18,19,20],生存获益优势有待进一步探索评估。
然而,包括第三代药物在内,目前已上市的EGFR-TKI多为BBB外排蛋白底物[10]。在治疗过程中,发现存在CNS转移的耐药机制有不同于颅外转移的情况,提示可能存在颅内药物浓度暴露不足和不能维持有效暴露浓度的问题:第一代EGFR-TKI治疗后出现颅内进展时T790M耐药突变比例低于5-17%[11,12],而发生颅外进展时T790M突变率可达63% [13]。第三代EGFR-TKI如奥希替尼治疗发生软脑膜转移时,绝大多数 (97.1%)患者脑脊液(CSF)中存在Exon 19 del或L858R突变;对于奥希替尼治疗前存在T790M突变(肿瘤组织或血浆检测)的患者,发生软脑膜转移时CSF中检测21.7%患者伴T790M阳性;最常见共突变为TP53, EGFR扩增和CDKN2A,C797S发生率为6%[14]。提示临床需要具BBB更高通透性和CNS高活性的药物以进一步加强对CNS转移患者的临床治疗。
一个EGFR-TKI化合物,既要满足EGFR靶点结合药效,又要兼顾CNS活性,在成药性上极富挑战。由阿斯利康联合江苏晨泰医药共同开发的新一代EGFR-TKI盐酸佐利替尼(AZD3759)的设计理念即是如此,是专门为伴CNS转移的EGFR敏感突变的晚期NSCLC患者的临床需求而开发:经过不断地筛选和尝试,克服各种技术困难,最终通过保留EGFR靶点作用的喹唑啉苯胺母核,采用增加化合物亲脂性,减少氢键供体,删除或替换带负电的原子以降低tPSA,去除碱性基团以降低pKa,以及引入受约束的构象提高分子刚性等技术优化药物分子理化性质。成功开发出佐利替尼(AZD3759),显著提高药物的BBB通透性,并成功实现独特的非外排蛋白底物特性,形成针对BBB突破性的生物学优势,可以更大程度满足CNS治疗需求。
图2 盐酸佐利替尼(AZD3759)
表1 EGFR-TKIs的血脑屏障通透性比较[10,15]
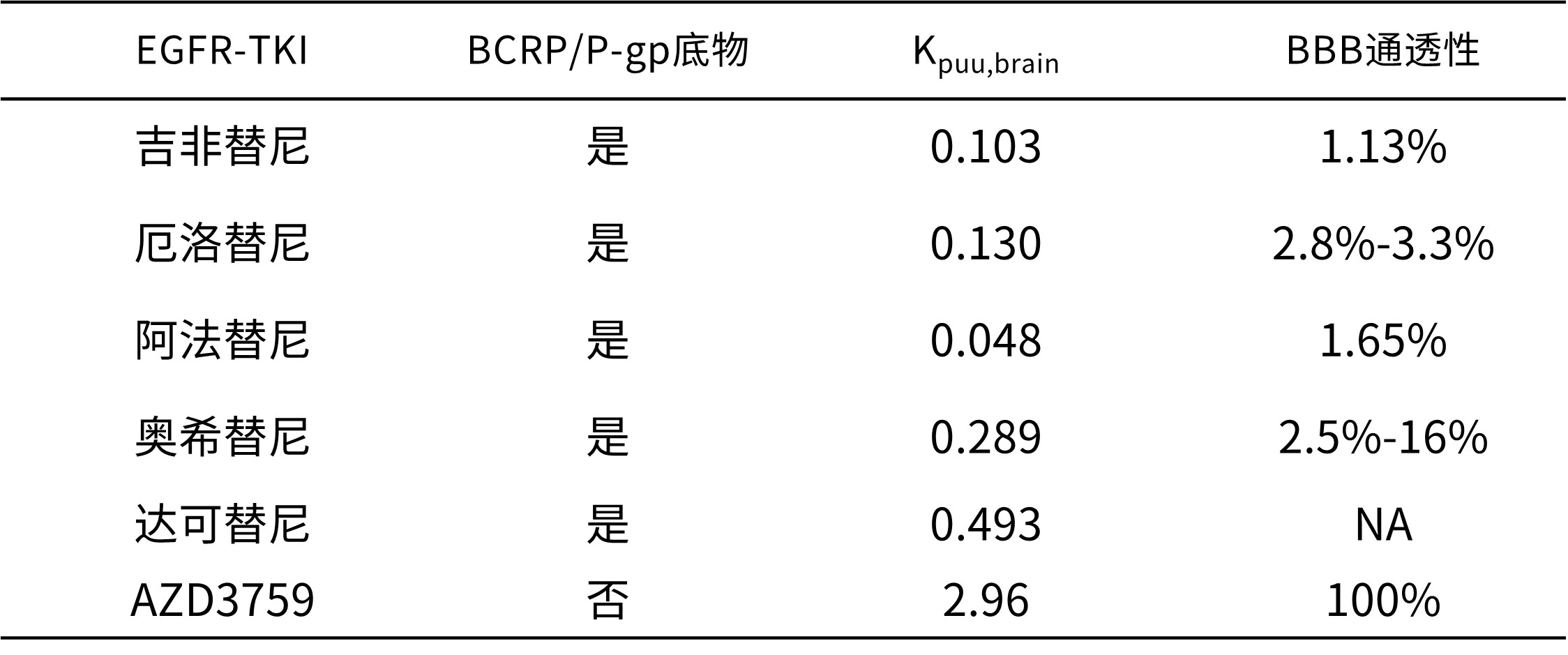
Kpuu,brain:脑中游离药物浓度与血浆中游离药物浓度的比值;NA:不适用。
佐利替尼(AZD3759)经临床前和临床评估,BBB通透性高达100%,在1期和2期临床研究中也显示出很好的CNS活性[10,16]。目前已完成的全球第一个专门针对CNS转移患者的国际多中心随机对照3期临床研究EVEREST,入组患者全部伴发CNS转移且既往未经过颅内放疗,其中包含超过20%有CNS转移症状,超过半数L858R,超过半数颅内病灶数大于3个的患者,该研究结果验证了佐利替尼(AZD3759)单药治疗伴CNS转移的EGFR敏感突变晚期NSCLC患者的疗效和安全性。
目前已报道的各类EGFR-TKI脑转移治疗数据绝大多数来自分层数据,随着EVEREST研究的数据发布,将为肺癌脑转移治疗的科学认知带来什么不同?是否会影响现有的临床治疗模式?敬请期待《伴中枢神经系统转移的EGFR敏感突变非小细胞肺癌的药物治疗——尚未终结的临床挑战(循证篇)》。
参考文献
[1] Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015;88(1):108–111.
[2] Li YS, Jiang BY, Yang JJ, et al. Leptomeningeal metastases in patients with NSCLC with EGFR mutations. J Thorac Oncol. 2016;11(11):1962-1969.
[3] Ramotar M, Barnes S, Moraes F, et al. Neurological Death is Common in Patients With EGFR Mutant Non-Small Cell Lung Cancer Diagnosed With Brain Metastases. Adv Radiat Oncol. 2019;5(3):350-357.
[4] Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. J Clin Oncol. 2011;29(2):134-141.
[5] Eichler AF, Kahle KT, Wang DL, et al. EGFR mutation status and survival after diagnosis of brain metastasis in nonsmall cell lung cancer. Neuro Oncol. 2010;12(11):1193-1199.
[6] Liu, HR. (2019). Clinical analysis and gene testing of lung adenocarcinoma with brain metastasis. [Doctoral issertation, Tianjin Medical University]. DOI:10.27366/d.cnki.gtyku.2019.000159
[7] Peters S, Bexelius C, Munk V, Leighl N. The impact of brain metastasis on quality of life, resource utilization and survival in patients with non-small-cell lung cancer. Cancer Treat Rev. 2016;45:139-162.
[8] Preusser M, Winkler F, Valiente M, et al. Recent advances in the biology and treatment of brain metastases of non-small cell lung cancer: summary of a multidisciplinary roundtable discussion. ESMO Open. 2018;3(1):e000262.
[9] Shetty V, Babu S. Management of CNS metastases in patients with EGFR mutation-positive NSCLC. Indian J Cancer. 2019;56(Supplement):S31-S37.
[10] Cheng H, Perez-Soler R. Leptomeningeal metastases in non-small-cell lung cancer. Lancet Oncol. 2018;19(1):e43-e55.
[11] Wang ZF, Ren SX, Li W, et al. Frequency of the acquired resistant mutation T790 M in non-small cell lung cancer patients with active exon 19Del and exon 21 L858R: a systematic review and meta-analysis. BMC Cancer. 2018;18(1):148. doi: 10.1186/s12885-018-4075-5.
[12] Yang Z, Guo Q, Wang Y, et al. AZD3759, a BBB-penetrating EGFR inhibitor for the treatment of EGFR mutant NSCLC with CNS metastases. Sci Transl Med. 2016 Dec 7;8(368):368ra172. doi: 10.1126/scitranslmed.aag0976.
[13] Yu HA, Arcila ME, Rekhtman N, et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res. 2013;19(8):2240-2247.
[14] Zheng MM, Li YS, Tu HY, et al. Genotyping of Cerebrospinal Fluid Associated With Osimertinib Response and Resistance for Leptomeningeal Metastases in EGFR-Mutated NSCLC. J Thorac Oncol. 2021;16(2):250-258.
[15] Kim M, Laramy JK, Mohammad AS, et al. Brain Distribution of a Panel of Epidermal Growth Factor Receptor Inhibitors Using Cassette Dosing in Wild-Type and Abcb1/Abcg2-Deficient Mice. Drug Metab Dispos. 2019;47(4):393-404.
[16] Ahn MJ, Kim DW, Cho BC, et al. Activity and safety of AZD3759 in EGFR-mutant non-small-cell lung cancer with CNS metastases (BLOOM): a phase 1, open-label, dose-escalation and dose-expansion study. Lancet Respir Med. 2017;5(11):891-902.
[17] Liu SY, Zhou Q, Lu C, et al. Efficacy and safety of AZD3759 in previously untreated EGFR-mutant non-small cell lung cancer with central nervous system metastases in a multi-center, phase II umbrella trial (CTONG1702). J Thorac Oncol. 2023;18(4):S52.
[18] Reungwetwattana T, Nakagawa K, Cho BC, et al. CNS Response to Osimertinib Versus Standard Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors in Patients With Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 2018 Aug 28:JCO2018783118. doi: 10.1200/JCO.2018.78.3118.
[19] Lu S, Dong XR, Jian H, et al. Aumolertinib activity in patients with CNS metastases and EGFR-mutated NSCLC treated in the randomized double-blind phase III trial (AENEAS).Journal of Clinical Oncology. 2022 40:16_suppl, 9096-9096.
[20] Shi Y, Chen G, Wang X, et al. Central Nervous System Efficacy of Furmonertinib (AST2818) Versus Gefitinib as First-Line Treatment for EGFR-Mutated NSCLC: Results From the FURLONG Study. J Thorac Oncol. 2022;17(11):1297-1305.
图1. D. Gomez-Zepeda. ABC transporters at the Blood-Brain Interfaces, their study models, and drug delivery implications in Gliomas. Pharmaceutics 2020,12,20; doi: 10.3390/pharmaceutics 12010020;